全球CAR-T疗法第一梯队 10款体内研发管线盘点与生物技术开发趋势
嵌合抗原受体T细胞(CAR-T)疗法在血液肿瘤治疗中已取得革命性成功,但传统的体外制备流程复杂、成本高昂、生产周期长。为突破这些瓶颈,全球生物技术公司正竞相开发“体内”(in vivo)CAR-T疗法,即通过直接将基因递送载体注射到患者体内,在体内对T细胞进行原位工程化改造。这有望将CAR-T疗法转化为一种更便捷、可及性更高的“现成”治疗模式。以下盘点了目前处于全球研发第一梯队的10款体内CAR-T临床在研管线,并探讨其背后的技术路径与开发生态。
第一梯队体内CAR-T临床在研管线盘点
- CAP-001(Capstan Therapeutics)
- 技术平台:基于脂质纳米颗粒(LNP)递送mRNA,靶向CD19。其核心是将编码CAR的mRNA和靶向T细胞的配体共同封装于LNP中,LNP在体内将mRNA选择性递送至T细胞,实现瞬时CAR表达。
- 开发阶段:临床前/早期临床阶段,专注于自身免疫性疾病(如系统性红斑狼疮)的探索。
- CB-010(Caribou Biosciences)
- 技术平台:利用CRISPR-chRDNA基因编辑技术和腺相关病毒(AAV)载体递送。旨在通过一次治疗,在体内同时敲除T细胞的PD-1基因并插入靶向CD19的CAR序列,以增强抗肿瘤活性。
- 开发阶段:已进入针对B细胞非霍奇金淋巴瘤的I期临床试验(ANTLER研究)。
- 体内CAR-T项目(Ensoma)
- 技术平台:基于工程化腺病毒(Engenious™ AAV)载体,能够高效感染造血干细胞和祖细胞(HSPCs)及T细胞,实现长期、稳定的基因修饰。目标是实现“一次治疗,终身受益”。
- 开发阶段:临床前开发中,与武田(Takeda)合作推进。
- VOR33(Vor Biopharma)
- 技术平台:虽然严格意义上不是典型的体内CAR-T,但其思路具有启发性。通过体外编辑造血干细胞(敲除CD33),回输后产生对CD33靶向疗法(如抗体药物偶联物)“免疫”的血液系统,从而在治疗AML时保护健康细胞。其体内策略正在探索中。
- 开发阶段:相关技术处于临床开发阶段。
- 体内CAR-T项目(Intellia Therapeutics)
- 技术平台:凭借其在体内CRISPR基因编辑领域的领先地位,Intellia正探索将LNP递送的CRISPR系统与CAR基因模板结合,在体内对T细胞基因组进行精准整合。
- 开发阶段:临床前研究阶段。
- IMC-001(Immatics与Bristol Myers Squibb合作)
- 技术平台:基于T细胞受体(TCR)的体内疗法,使用病毒载体将肿瘤特异性TCR基因递送至患者T细胞。虽然非CAR结构,但代表了体内工程化T细胞疗法的另一重要分支。
- 开发阶段:早期临床开发中。
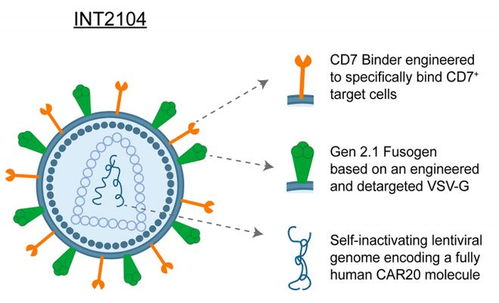
- 体内CAR-T项目(Sana Biotechnology)
- 技术平台:开发低免疫原性的病毒载体(如Fusogenix载体),旨在逃避宿主免疫系统的中和,实现重复给药和高效体内基因递送至T细胞。
- 开发阶段:临床前开发阶段。
- ARTEMIS™平台衍生项目(Adicet Bio与驯鹿生物合作)
- 技术平台:虽然主力是通用型(异体)CAR-T,但其平台技术(如特定的CAR结构)和基因工程能力为未来开发体内递送策略奠定了基础。
- 开发阶段:同种异体现有管线已进入临床,体内方向在研。
- 体内CAR-T项目(Beam Therapeutics)
- 技术平台:利用其碱基编辑(Base Editing)技术,无需切断DNA双链即可实现精确的单碱基修改。正探索通过LNP将碱基编辑器和CAR模板递送入体内,对T细胞进行多重编辑,以创建更安全、高效的体内CAR-T。
- 开发阶段:临床前研究阶段。
- ACD项目(Allogene Therapeutics)
- 技术平台:作为通用型CAR-T的领导者,Allogene已布局“现成”体内CAR-T(称为ACD)。其思路可能是利用其先进的异体细胞平台技术与体内基因递送相结合,实现终极的“现成药”模式。
- 开发阶段:早期研发阶段。
核心技术路径与生物技术开发挑战
当前体内CAR-T的开发主要围绕三大核心技术展开竞争:
- 病毒载体(特别是AAV):优势是转导效率高,可实现长期表达;挑战是免疫原性、载体容量限制和潜在的基因组整合风险。
- 非病毒载体(主要是LNP-mRNA):优势是安全性高(瞬时表达)、可重复给药、生产工艺相对简单;挑战是靶向特异性、体内递送效率和对T细胞的持久性改造能力。
- 基因编辑工具(CRISPR、碱基编辑等)整合:旨在实现CAR基因的定点、稳定整合,同时可敲除免疫抑制基因(如PD-1),但技术复杂,脱靶效应和安全性是关注重点。
开发生态与未来趋势:
跨界融合:该领域呈现出mRNA技术、基因编辑、载体工程与免疫学深度交叉融合的特点。新兴生物技术公司(如Capstan, Caribou)与大型药企(如BMS, 武田)通过合作加速推进。
适应症拓展:早期探索已从血液肿瘤延伸至自身免疫性疾病、纤维化疾病等,潜力巨大。
* 核心挑战:精准的体内T细胞靶向、可控的CAR表达时长与水平、避免对非靶细胞的编辑、以及最终的成本与可及性,仍是研发需要攻克的堡垒。
###
体内CAR-T疗法代表了细胞治疗范式的下一次重大演进。尽管目前多数管线尚处于早期阶段,临床转化的道路上面临诸多科学和工艺挑战,但其一旦成功,将彻底改变细胞治疗的格局,使其真正成为一种可规模化、可负担的常规治疗选择。第一梯队的竞争已经展开,未来几年关键的临床概念验证数据将成为行业发展的风向标。
如若转载,请注明出处:http://www.xizhihongtec.com/product/62.html
更新时间:2026-02-24 02:47:33